Irreversibilität
contra Thermodynamik
Bei
der
thermodynamischen Betrachtungsweise von Gleichgewichten spielen
Überlegungen zu Reaktionsmechanismen bekanntlich keine Rolle.
Die Lage von Gleichgewichten berechnet man nach der Grundphilosophie,
dass man Zustände unter Energie- und
Entropieaspekten miteinander vergleicht und daraus die
Gleichgewichtslage berechnet. Die Thermodynamik beschreibt nicht das
Verhalten von einzelnen Atomen/Molekülen sondern nur die
Auswirkungen von sehr vielen von ihnen in bezug auf Druck,
Temperatur und andere Zustandsgrößen. Da die
Vielzahl der atomaren/molekularen Prozesse ursächlich
für die Gleichgewichtslage verantwortlich ist, soll ihr
Einfluß hier näher beschrieben werden.
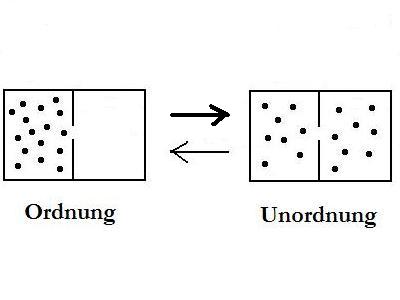
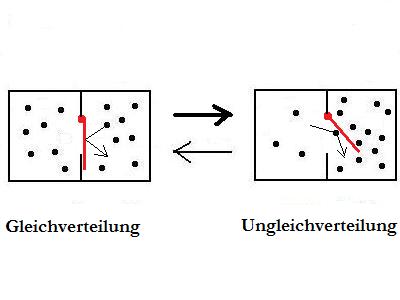
Im
Bild oben sind zwei
mögliche Verteilungszustände von
Atomen/Molekülen abgebildet. Nach thermodynamischer Logik hat
der unordentliche Zustand eine höhere Wahrscheinlichkeit als
der ordentliche. So banal richtig sich die Aussage auch
anhört, so falsch ist sie doch.
Es gibt keine
wahrscheinlichen Zustände, es gibt nur wahrscheinliche
Vorgänge.
Richtig wäre zu diesem
Bild die Aussage,dass der
Übergang vom ordentlichen in
den unordentlichen Zustand wahrscheinlicher ist als umgekehrt. So
spitzfindig sich dieser Satz auch anhört, so wichtig ist er
doch.
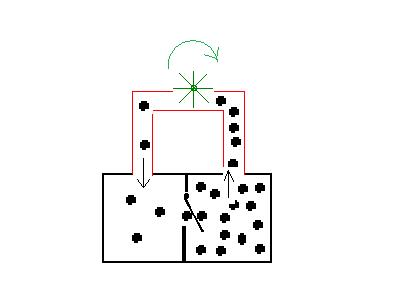
Durch die im Bild oben
eingefügte frei schwingende
Planke verändern sich die Verhältnisse grundlegend.
Weil die Planke nur in eine Richtung durchschwingen kann,
ist der
Vorgang von links nach rechts
wahrscheinlicher als der entgegengesetzte. Da die Kugeln nur von links
nach
rechts die Tür aufstoßen
können, hat man an
dieser
Stelle einen irreversiblen
Vorgang. Hier wird der Fehler sichtbar, dass man
Zuständen (Ordnung/Unordnung) keine Wahrscheinlichkeit
zuordnen darf. Im Gleichgewicht hat man somit eine Ungleichverteilung,
obwohl nach Energie/Entropiewerten die gleichen Verhältnisse
vorliegen wie oben.
Ein Gleichgewicht, welches sich durch
irreversible Vorgänge
einstellt, ist thermodynamisch ein Ungleichgewicht . Aus einem
thermodynamischen Ungleichgewicht kann man aber immer, wie im Bild
durch das Rad symbolisiert, einen gewissen Anteil Nutzarbeit
herausziehen . Man hat ein Perpetuum mobile 2. Art.
Systeme, in denen
reversible Elementarprozesse das
Gleichgewicht bestimmen, sind mit thermodynamischen Formeln korrekt zu
berechnen. Hat man dagegen Systeme, in denen
irreversible Elemtarprozesse von
Bedeutung sind, kommt der logische Fehler, Zuständen
(Ordnung/Unordnung) eine Wahrscheinlichkeit zuzuordnen, zum tragen. Der
2. Hauptsatz der Thermodynamik hat dort keine Gültigkeit. Levenspiel's
Springbrunnen , der Tropftrichter
und auch die Molekulare Ratsche von Feynmann sind
kongrete Beispiele für solche Systeme.
zurück
weiter
<